已知反应mX(g)+nY(g)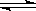 qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
如图,电解用粗盐(含 、
、 、
、 等杂质)配制的食盐水,以下说法正确的是
等杂质)配制的食盐水,以下说法正确的是
| A.a是电解池的正极 | B.a电极上发生还原反应 |
| C.b电极附近有白色沉淀出现 | D.b电极上有黄绿色气体产生 |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有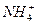 、
、 、
、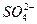 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有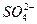 |
D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶 液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有 液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有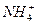 |
关于胶体和溶液的区别,下列叙述中正确的是
| A.溶液呈电中性,胶体带有电荷 |
| B.溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷 |
| C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 |
D.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的 光带 光带 |
下列物质固态时熔点的比较正确的是
| A.F2>C12>Br2 | B.金刚石>NaCl>O2 |
| C.S>NaBr>金刚石 | D.N a>CH4>冰 a>CH4>冰 |
下列叙述正确的是
| A.复分解反应不一定不是氧化还原反应 |
B.只有一种生成物的化学 反应不一定是化合反应 反应不一定是化合反应 |
| C.有阳离子存在的物质中一定存在阴离子 |
| D.离子反应一定是复分解反应 |