下列热化学方程式,正确的是( )
| A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ  ·mol-1 ·mol-1 |
B.稀的强酸和稀的强碱溶液反应的热化学方程式均为: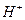 +OH-H2O(1); +OH-H2O(1);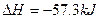 ·mol-1 ·mol-1 |
| C.在25℃、101 kPa时,1克H2完全燃烧生成H2O放出热量142.9kJ。则: 2H2O(1)2H2(g)+O2(g);△H= +571.6kJ·mol-1 |
| D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: |
N2(g)+3 H2(g) 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
只需用一种试剂即可将酒精、苯酚溶液、四氯化碳、己烯、甲苯五种无色液体区分开来,该试剂是()
| A.FeCl3溶液 | B.溴水 | C.KMnO4溶液 | D.金属钠 |
已知二甲醚和乙醇是同分异构体,下列鉴别方法中不可行的是
| A.利用金属钠 | B.利用质谱法 | C.利用红外光谱法 | D.利用核磁共振氢谱 |
已知反应:①Cl2+2KBr===2KCl+Br2,②KClO3+6HCl===3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2===Br2+2KClO3,下列说法正确的是 ( )
| A.氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2 |
| B.①中KCl是氧化产物,KBr发生还原反应 |
| C.③中1 mol氧化剂参加反应得到电子的物质的量为2 mol |
| D.反应②中氧化剂与还原剂的物质的量之比为1∶6 |
下列说法正确的是 ( )
| A.分解反应一定是氧化还原反应 |
| B.非金属单质在氧化还原反应中一定作氧化剂 |
| C.氧化剂具有氧化性,还原剂具有还原性 |
| D.氧化剂在氧化还原反应中被氧化 |
下列离子方程式正确的是
| A.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
| B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
| C.氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓ |
| D.CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ |