已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1 = 4.3×l0_7 K2 = 5.6×l0_11 |
现维持25℃,下列有关说法正确的是 ( )
| A.NaHCO3溶液中:c(OH-)-c(H+) = c(H2CO3)-c(CO32-) |
| B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中 c(Na+)>c(CN-),则a一定小于b |
| C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D.等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa) |
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
| A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C.c(Fe3+)=0.1 mol·L-1的溶液:H+、Al3+、Cl-、SCN- |
D. =0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3- =0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3- |
下列化学用语表示正确的是
A.N2分子的电子式: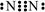 |
B.中子数为18的氯原子的原子符号: |
C.CH4分子的球棍模型: |
D.HOCH2COOH缩聚物的结构简式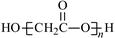 |
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
| A.减少CO2的排放,可以减少酸雨的产生 |
| B.减少SO2的排放,可以从根本上消除雾霾 |
| C.“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| D.用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D.0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+) |
短周期金属元素甲~丁在元素周期表中的相对位置如表所示: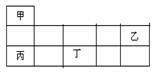
下列判断正确的是( )
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |