常温下,浓度均为0.1 mol·L-1的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨 水
水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时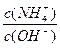 的值
的值
将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如下图所示:
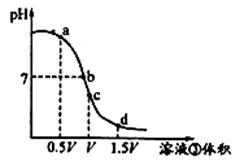
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点;
②取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,其它离子浓度由大到小的顺序是 。
下列为A、B、C、D四种物质的转化关系,a、b为反应条件,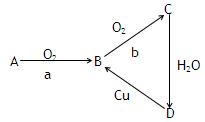
(1)若A为单质,a为点燃,b为催化剂、加热,则A为(填写化学式),
写出B→C的方程式。
(2)若A为气态化合物,B→C转化不需要条件,则A为(填写化学式),
写出A→B化学方程式 。
。
写出Cu+D溶液→B的离子方程式。
(3)把某黑色固体Y加热至红热,投入到上述某种无色溶液D中产生两种气体组成的混合气体X,将X做如下所示实验:
写出M、G所代表物质的化学式MG
A、B、C、D、E五种常见物质,均为可溶于水的固体,两种物质的焰色反应为黄色,且二者 的溶液混合会产生无色无味气体。组成它们的离子有
的溶液混合会产生无色无味气体。组成它们的离子有
| 阳离子 |
Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、SO42-、HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们分别是(写化学式)
A;B;C;D;E。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在适合的反应条件下,它们可以按照下面框图进行反应。又知E是无色溶液,请回答: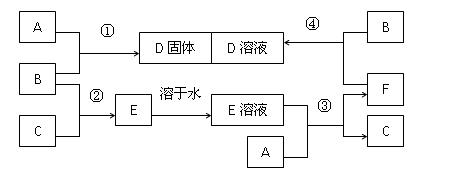
(1)B溶于水的离子方程式 。
。
(2)反应④的离子方程式为。
(3)向F的溶液中加入烧碱溶液后在空气中静置,可观察到的现象有。
将O2、NO、NH3、HCl分别 收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为。(不考虑N2O4的存在)
收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为。(不考虑N2O4的存在)
如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)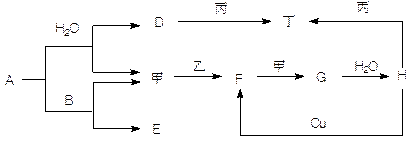
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________
(2)写出下列反应的化学方程式:A与B ______________________________
Cu与H ________________________________
(3)写出丙与D溶液反应的离子方程式 ________________________________
(4)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是
。