(14分) 300℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
(1该反应的平衡常数表达式为:K= 。已知K300℃<K350℃,
则△H 0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为 ,D的平均反应速率为 。
(3)若温度不变,缩小容器容积,则A的转化率 (填“增大”减小”或 “不变”),
原因是 。
(4)如果在相同的条件下,上述反应从 逆反应方向进行,开始时若加入C、D各
逆反应方向进行,开始时若加入C、D各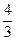 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第2周期_____>_____>H2O、HF;第3周期SiH4>PH3>_____>_____。
(2)化合物的毒性:PH3>NH3;H2S_____H2O;CS2_____CO2;CCl4>CF4。(填“>”“<”或“=”)。
于是科学家们开始把注意力集中在F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新的制冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的制冷剂氟利昂CF2Cl2终于诞生了,其他类似的还可以是_____。
(4)然而,这种制冷剂造成了当今的某一环境问题是_____,但求助于周期表中元素及其化合物的_____变化趋势来开发制冷剂的科学思维方法是值得借鉴的。(填写字母)
①毒性②沸点③易燃性④水溶性⑤颜色
A.①②③ B.②④⑤ C.②③④
完成下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_____。
(2)周期表中位于第8纵行的铁元素属于第_____族。
(3)周期表中最活泼的非金属元素位于第纵_____行。
(4)所含元素超过18种的周期是第_____、_____周期。
A、B、C为短周期元素,在周期表中所处位置如右图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称:_____、_____、_____。
(2)B位于元素周期表中第_____周期,第_____族。
(3)C的原子结构示意图为_____,C的单质与水反应的化学方程式为_______________。
(4)比较B、C的原子半径_____,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式____________________。
某元素R有4个电子层,最外层上有5个电子,指出:
(1)R在第_____周期,第_____族,元素符号_____。
(2)R的最高正价_____,负价_____,最高价氧化物化学式_____,对应水化物化学式_____,氢化物化学式_____。
实验室为验证同主族元素性质递变规律,准备了如下药品:
①AgNO3(aq)②稀HNO3③Br2(aq)④I2(aq)⑤NaOH(aq)⑥NaCl(aq)⑦NaBr(aq)⑧H2O⑨Na⑩镁条⑪铝条⑫K
(1)你准备选用的药品是(用编号表示)______。
(2)你所做的实验是什么(用方程式表示)?判断依据是什么?