和500mL 0.1mol/L MgCl2溶液中Cl-浓度相等的是
| A.500mL 0.2mol/L KClO3溶液 | B.1L 0.1mol/L的KCl溶液 |
| C.100mL 0.1mol/L CaCl2溶液 | D.200mL 0.1mol/L的AlCl3溶液 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) |
| B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: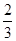 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的PH=7 |
C.混合溶液中,c(H+)= 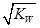 mol.L-1 mol.L-1 |
| D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-) |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
室温时,M(OH)2(S)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
A.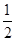 lg( lg(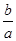 ) ) |
B.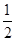 lg( lg(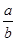 ) ) |
C.14+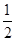 lg( lg(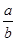 ) ) |
D.14+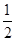 lg( lg(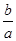 ) ) |
室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
| A.溶液的体积:10V甲≤V乙 |
| B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D.若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |