有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯隔绝空气加热至恒重并排除气体后恢复到常温,测得的数据如下:则下列叙述不正确的是
| |
第一份 |
第二份 |
| 混合物的质量(g) |
9.2 |
20.8 |
| 反应后固体的质量(g) |
8.3 |
15.9 |
| A.第二份得到的是纯净物 |
| B.第一份混合物中NaOH的质量分数更大 |
| C.根据表中数据不能计算出第一份混合物中NaHCO3的质量分数 |
| D.第二份混合物中NaOH的物质的量小于NaHCO3的物质的量 |
如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是()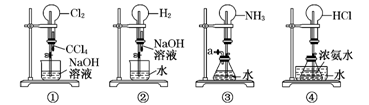
| A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹 |
| B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
| C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 |
| D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹 |
在给定条件下,下列加点的物质在化学反应中完全消耗的是()
| A.加热条件下,将1g铝片投入20mL 18.4mol/L的硫酸中 |
| B.常温下,向100mL 3mol/L的硝酸中加入6.4gCu |
| C.在适当温度和催化剂作用下,用2mol SO2和1mol O2合成SO3 |
| D.实验室用足量的MnO2与一定量的浓HCl反应制备Cl2 |
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1: 6,则该反应的还原产物是()
| A.NO | B.NO2 | C.N2O | D.NH4NO3 |
下述实验能达到预期目的的是()
| 编号 |
实验内容 |
实验目的 |
| A |
将含有HCl杂质的CO2通入饱和Na2CO3溶液中 |
除去CO2中的HCl |
| B |
将适量一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 |
分离出NaCl晶体 |
| C |
在淀粉-KI溶液中滴加少量市售食盐配制的溶液 |
鉴别真假碘盐 |
| D |
将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 |
检验Fe(NO3)2试样是否变质 |
下列制备和收集气体的实验装置合理的是()