现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为_______________________ _________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________ ;
(3)通气后,应先点燃 处的酒精灯,再点燃 处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?________ __,
原因是__ __ __;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:
______________________________________________________________________
(5)已知Mg3N2是离子化合物,请写出其电子式 ;
证明Mg3N2是离子化合物实验依据是 。
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
(1)化合物C的分子式是C8H10O,C遇FeCl3溶液显紫色,C苯环上的一溴代物只有两种,则C的结构简式可能为 (写出一种即可)。
(2)D为一直链化合物,其相对分子质量比化合物C的小34,它能跟NaHCO3反应放出CO2,则D结构简式为 。
(3)反应①的化学方程式是 。
(4)芳香族化合物B是与A具有相同官能团的同分异构体,通过反应②化合物B能生成E和F,E苯环上的一溴代物只有一种,E可能的结构简式是:
。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。反应过程中生成甲醇的物质的量与温度、时间的变化曲线如图所示
CH3OH(g)。反应过程中生成甲醇的物质的量与温度、时间的变化曲线如图所示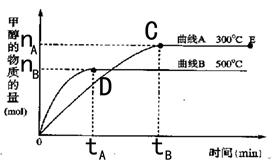
根据题意完成下列各题:
(1)在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)= (用nA和tA表示)。
(2)根据图示曲线判断合成甲醇的反应为 (填“吸热”或“放热”)反应,理由是 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是( )
| A.正、逆反应速率均加快 | B.CO的浓度减少 |
| C.甲醇的物质的量减少 | D.重新平衡时n(CH3OH) / n(H2)增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
(用化学方程式表示)
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是:
(用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是 ,
反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。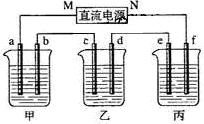
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为;
(2)计算电极e上生成的气体在标准状态下的体积:;
(3)电解后甲溶液的pH(填“增大”、“减小”或“不变”),简述其原因:;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。
(1)写出M和过量的固体甲反应的化学方程式:
(2)如图表示的是生产酸G的工业流程:
①设备乙的名称为;
②气体X的主要成分为;
③写出设备甲中常见的化学反应;
(3)固体乙与M反应的化学方程式为。