某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( ) 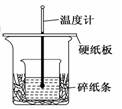
| A.如图条件下实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高。 |
某CaCl2样品中可能混有FeCl3、MgCl2、NaCl、Na2CO3中的一种或两种杂质,取11.1 g样品溶解,得无色溶液,再加入足量的AgNO3溶液得29.7 g沉淀,由此可知,样品所含杂质的正确结论是()
| A.一定无Na2CO3,可能有MgCl2 | B.一定有FeCl3,可能有NaCl |
| C.一定有MgCl2,可能有NaCl | D.一定有NaCl |
现有KCl和KBr的混合物3.87 g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63 g沉淀物,则原混合物中钾元素的质量分数为()
| A.24.1% | B.25.9% | C.40.3% | D.48.1% |
下列离子方程式书写正确的是()
| A.氯气和水的反应:Cl2+H2O====2H++Cl-+ClO- |
B.向漂白粉溶液中通入过量的二氧化碳:ClO-+CO2+H2O====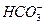 +HClO +HClO |
| C.二氧化锰与浓盐酸反应:MnO2+4HCl====Mn2++2Cl-+Cl2↑+2H2O |
| D.溴化钠与氯水反应:Br-+Cl2====Br2+Cl- |
碘元素有多种价态,可以形成多种含氧阴离子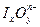 。由2个I
。由2个I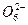 正八面体共用一个面形成的
正八面体共用一个面形成的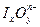 的化学式为()
的化学式为()
A.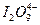 |
B.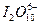 |
C.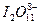 |
D.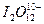 |
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小;把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成分是()
| A.HCl和CO | B.HCl、H2和CO |
| C.CH4和NH3 | D.HCl、CO和CO2 |