下列化学实验事实及其解释都正确的是
| A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应 |
| B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 |
| C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑ |
该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
化学反应原理中涉及很多常数,下列说法错误的是()
A.反应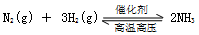 的化学平衡常数表达式为 的化学平衡常数表达式为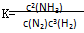 |
| B.化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 |
| C.对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 |
| D.将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
以惰性电极电解500mL0.4mol/L的CuCl2溶液。若阳极上所产生气体的物质的量为0.25mol,则阴极上析出Cu的质量为()
| A.16g | B.32g | C.19.2g | D.12.8g |
25 ℃时,水的电离达到平衡:H2O H++OH-;DH>0,下列叙述正确的是()
H++OH-;DH>0,下列叙述正确的是()
| A.向水中加入稀氨水,平衡逆向移动, KW减小 |
| B.向水中加入少量固体硫酸钠,平衡不移动,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体NH4Cl,平衡正向移动,c(H+)降低 |
一定温度下,对可逆反应 A(g)+ B(g) 2C(g)的下列叙述中,能说明反应已达到平衡的是()
2C(g)的下列叙述中,能说明反应已达到平衡的是()
| A.单位时间内消耗amolA,同时生成2amolC |
| B.C生成的速率与C的分解速率相等 |
| C.若容器体积不变,容器内的压强不再变化 |
| D.混合气体的物质的量不再变化 |
已知在1×105Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是 ( )
| A.H2O(g) ="=" H2(g)+1/2 O2(g);△H1=+242 kJ·mol-1 |
| B.2 H2(g)+ O2(g)="==2" H2O(l);△H2=- 484 kJ·mol-1 |
| C.H2(g)+1/2 O2(g)====H2O(g) ;△H1=+242 kJ·mol-1 |
| D.2 H2(g)+ O2(g)="==2" H2O(g);△H2=+484 kJ·mol-1 |