含MgCl2、FeCl3、Al2(SO4)3三种溶质的混合溶液中,已知Cl-为1.5mol,Al3+和Fe3+共0.5mol,Mg2+为0.5mol,则SO42—的物质的量为
| A.1mol | B.0.5mol | C.0.25mol | D.0.15mol |
如图所示,钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是 ( )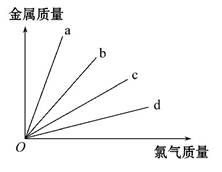
| A.a | B.b | C.c | D.d |
下图所示的烧瓶内装有新制的氯水,将其长时间放置在阳光下,溶液的pH变化正确的是 ( )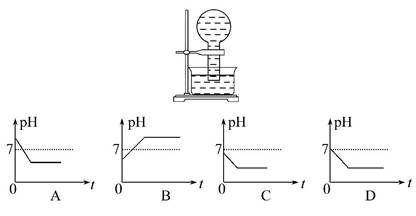
在同温同压下,将由H2和Cl2组成的混合气体200 mL引发化学反应,反应后的气体体积仍为200 mL。下列对化学反应状况的判断中正确的是 ( )
| A.若反应后的气体有刺激性气味,则一定是Cl2没有完全反应 |
| B.若反应后的气体没有颜色,则一定是H2和Cl2都已完全反应 |
| C.若反应后的气体略带黄绿色,则一定是H2已完全反应 |
| D.若反应后的气体遇水显漂白性,则一定是Cl2未完全反应 |
如图所示:若关闭弹簧夹Ⅰ,打开弹簧夹Ⅱ,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是 ( )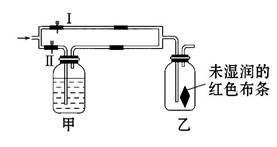
| A.浓硫酸 | B.NaOH溶液 |
| C.Ca(OH)2溶液 | D.NaCl溶液 |
新制氯水与久置的氯水相比较,下列结论错误的是 ( )
| A.颜色相同 |
| B.前者能使有色布条褪色 |
| C.都含有H+ |
| D.加AgNO3溶液都能生成白色沉淀 |