(1)在标准状况下,有下列物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2。其
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:
已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(3)写出实验室制取氯气的化学方程式 。
水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1
CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 |
c(H2O) /mol·L-1 |
c(CO) /mol·L-1 |
c(H2) /mol·L-1 |
v正、v逆比较 |
| Ⅰ |
0.06 |
0.60 |
0.10 |
v正=v逆 |
| Ⅱ |
0.06 |
0.50 |
0.40 |
① |
| Ⅲ |
0.12 |
0.40 |
0.80 |
v正<v逆 |
| Ⅳ |
0.12 |
0.30 |
② |
v正=v逆 |
① ,② 。
在T温度下该反应的化学平衡常数为 。
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)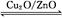 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: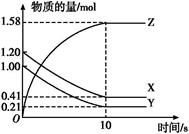
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示: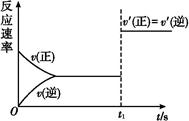
则下列说法符合该图像的是 。
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp/25 ℃ |
2.0×10-16 |
4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
如图是元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。请回答下列问题:
(1)若X单质为空气的主要成分之一,则W原子结构示意图为 。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,则这两种离子的符号是 、 。
(3)若Na与Y和Z的单质分别反应可以生产摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为 ,所含化学键的类型为
(4)Y元素在周期表中可能处于第 纵行(写出所有可能纵行数)。
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: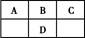
(1)设A、B、C、D四种元素的原子序数之和为m,则m 。
A.一定为奇数
B.一定为偶数
C.可能为奇数,也可能为偶数
(2)D元素原子的次外层电子数等于其他层电子数之和,则:
①写出A形成的简单离子的结构示意图 ,元素D位于元素周期表的第 族。
②A元素的一种氢化物分子中有6个原子,其结构简式为 。常压298 K时0.2 mol该气态氢化物在O2中完全燃烧,生成气态A单质和水,放出热量106.8 kJ,该气态氢化物燃烧的热化学方程式为 。
③写出C单质与B的最简单氢化物反应的化学方程式:
④实验证实AC3与水会发生反应生成HNO2和HF,则AC3和NaOH溶液反应的化学方程式为 。