有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
铜锌原电池(如右图)工作时,下列叙述正确的是 
| A.正极反应为:Zn—2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2+ +Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
理论上,不能设计为原电池的化学反应是: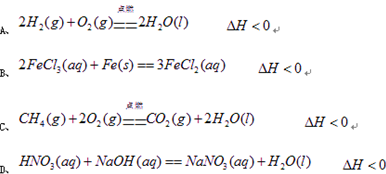
有关AgCl沉淀的溶解平衡说法正确的是()
| A.AgCl沉淀生成和沉淀溶解不断进行并且速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度减小 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解平衡不移动 |
电解CuSO4溶液时,若要求达到如下三点要求:①阳极质量减少②阴极质量增加③电解液中c(Cu2+)不变,则可选用的电极是()
| A.纯铜作阳极,含Zn、Ag的铜合金作阴极 |
| B.含Zn、Ag的铜合金作阳极,纯铜作阴极 |
| C.用纯铁作阳极,用纯铜作阴极 |
| D.用石墨作阳极,用惰性电极(Pt)作阴极 |
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
| A.1∶2∶3 | B.3∶2∶1 | C.6∶3∶1 | D.6∶3∶2 |