镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校研究性学习小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 饱和溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。写出有关反应的离子方程式 。
(2)右图是该校研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是 。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是 。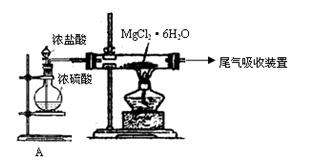
(3)写出过程④中发生反应的化学方程式 。该过程得到的镁蒸气需要在特定的循环中冷却,应选用 (填试剂名称)作冷却剂。
孔雀石的主要成分为Cu2(OH)2CO3。某校化学兴趣小组的同学设计从孔雀石中冶炼铜的方案如下: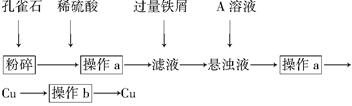
回答下列问题:
(1)在粉碎后的孔雀石中加入稀硫酸,观察到的现象是_______________。
反应的离子方程式是___________________________________________。
(2)操作a中用到的玻璃仪器是____________________________________。
(3)A的化学式为________,在悬浊液中加入A的目的是______________。
(4)操作b包括洗涤和低温烘干,作用是__________________________。
(5)有同学认为,利用铁屑和稀硫酸,不通过上述实验方案,也能从孔雀石中冶炼铜。请你用简洁的文字说明不同方案的实验原理__________________。
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生产中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中含有的大量阳离子是________。
(2)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下所示。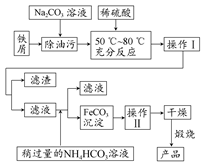
回答下列问题:
①操作Ⅰ所用的分离仪器的名称是________;操作Ⅱ的名称是________,该操作的具体方法是________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________。
③请写出生成FeCO3沉淀的离子方程式:________。
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________;
(2)过程Ⅰ加入铁屑的主要作用是________,分离得到固体的主要成分是______________,从固体中分离出铜需采用的方法是________________;
(3)过程Ⅱ中发生反应的化学方程式为______________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式计算)
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为。
(3)验证滤液B含Fe3+,可取少量滤液并加入(填试剂名称)。
(4)滤液E、K中溶质的主要成分是(填化学式),写出该溶质的一种用途:。
(5)已在298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: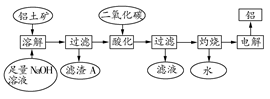
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式:。
(2)滤渣A的主要成分为;滤渣A的用途是(只写一种);实验室过滤时使用玻璃棒,其作用是。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是。
(4)若将铝溶解,下列试剂中最好选用(填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是。