工业上处理含有Cr2O72-的酸性工业废水,通常有两种处理方法。第一种方法是:先加入绿矾(FeSO4·7H2O),把废水中的Cr2O72-还原成Cr3+离子,再加入过量的石灰水,使Cr3+转变为Cr(OH)3沉淀。第二种方法是:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极 ,阴极 。
(2)Cr2O72-转变成Cr3+的离子反应方程式: 。
(3)采用第二种方法时,往工业废水里加入适量的NaCl的目的是 。
(4)能否用石墨电极来代替Fe电极? (填“能”或“不能”),简述理由:
。
如下图是常见仪器的部分结构。
(1)写出仪器名称A ,B ,C ,D 。
(2)使用前需检查是否漏水的仪器有 。
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是 ,pH由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 。
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为 。
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为 。
有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测:
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是 。
(2)若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
(3)该学生以上述方式测定下列溶液的pH,无误差的是( )
| A.NaOH | B.CH3COONa | C.NaCl | D.NaHSO4 |
下表是几种常见弱酸的电离常数(25 ℃)。
| 酸 |
电离方程式 |
电离常数K |
| CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
| H2CO3 |
H2CO3 H++HC H++HCHC  H++C H++C |
K1=4.4×10-7 K2=4.7×10-11 |
| H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 |
H3PO4 H++H2P H++H2PH2P  H++HP H++HPHP  H++P H++P |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? 。
(3)若把CH3COOH、H2CO3、HC、H2S、HS-、H3PO4、H2P、HP都看成是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离常数,对于同一种多元弱酸的K1、K2、K3之间存在着一定的规律,此规律是 ,产生此规律的原因是 。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答: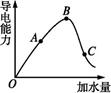
(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)=0.1 mol·L-1,c(CH3COO-)=0.01 mol·L-1,则该条件下CH3COOH的电离常数Ka= 。