氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) 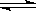 H2(g) + CO(g) △H = +131.3 kJ·mol-1,△S =" +133.7" J/K
H2(g) + CO(g) △H = +131.3 kJ·mol-1,△S =" +133.7" J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g)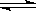 2NH3(g) △H<0 的K=0.5,
2NH3(g) △H<0 的K=0.5,
①2NH3(g)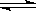 N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
V(N2)正 V(N2)逆(填:>、<、=、不能确定)
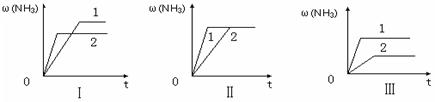
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能,1>2 |
现有乙酸、苯、苯酚、苯甲酸四种有机物组成的混合物,可按右面的图示程序进行分离(已知苯甲酸是微溶于水的白色晶体)。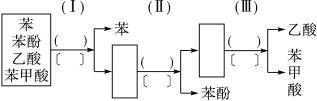
请在圆括号内填上适当的试剂名称,在方格号内填上分离操作的名称,在方框内填上适当物质的化学式。
20℃时,将10mL 0.1 mol/L  溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
溶解于酸所花的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
50 |
| E |
2 |
薄片 |
45 |
25 |
| F |
2 |
粉末 |
15 |
5 |
试求:
(1)画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(2)利用所画的曲线图,关于温度影响反应速率你能得出什么结论?
(3)20℃时,2g锌箔溶解于酸中需花多少时间?
(4)对比结果B与F,解释F为什么那么快?
下图为将Zn投入一定浓度体积的H2SO4中,解释图像的成因(纵坐标为H2的生成速率)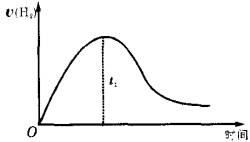
试将外界条件对化学反应速率的影响结果填入下表中。