某学生用 和
和 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2g |
15.7g |
27.6g |
 (标准状况) (标准状况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为 |
B.根据表中数据能计算出混合物中 的质量分数 的质量分数 |
| C.加入混合物9.2g的一组实验中盐酸过量 |
| D.15.7g混合物恰好与盐酸完全反应 |
下列化学用语使用不正确的是
| A. |
的结构示意图  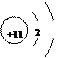  |
| B. | 纯碱的化学式为 |
| C. | 聚乙烯的结构简式为 |
| D. | 高氯酸(
)中氯元素的化合价为+7  |
下列关于化学学习和研究的说法错误的是()
| A. | 化学模型有助于解释一些化学现象 | B. | 质量守恒定律是大量实验事实的总结 |
| C. | 化学家提出的假设都能被实验证明 | D. | 化学基本原理的应用是有一定条件的 |
有一未完成的离子方程式:□□+XO3-+6H+ ="=" 3X2+3H2O,据此判断:X元素的最高化合价为()
| A.+7 | B.+5 | C.+4 | D.+1 |
某些化学试剂可用于净水。水处理中使用一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm. yH2O]x,式中m等于()
| A.3-n | B.6-n | C.6+n | D.3+n |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列是有说法中,不正确的是( )
| A.1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
B.NH5中既有共价键又有离子键 H H |
| C.NH5的电子式为:[H:N:H]+[:H]- H |
| D.它与水的反应的离子方程式为:NH4++H-+H2O=NH3·H2O+H2↑ |