下列叙述中正确的是
| A.金属阳离子被还原一定得到金属的单质 |
| B.在氧化还原反应中,非金属单质一定是氧化剂 |
| C.含金属元素的离子不一定都是阳离子 |
| D.某元素从化合态变为游离态时,该元素一定被还原 |
下列说法正确的是
| A.SiO2属于酸性氧化物只能和碱溶液反应生成盐和水 |
| B.晶体硅具有很好的导电性能,可用于生产光导纤维 |
| C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| D.油酯和糖类均能发生水解反应 |
在容积为2 L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g) cQ(g),正反应放热。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述错误的是
cQ(g),正反应放热。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述错误的是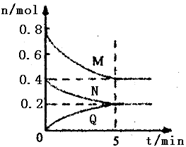
| A.该温度下此反应的平衡常数的值K=25 |
| B.若条件改为恒温恒压,则达平衡时M的转化率小于50% |
| C.相同条件下,若开始时向容器中充入0.4molQ,达到平衡时,M的体积分数等于50% |
| D.若条件改为绝热,则达平衡所需时间更短 |
下列说法正确的是
| A.滴有酚酞的氨水中加入少量NH4Cl固体,溶液颜色变深 |
| B.已知Mg(OH)2的Ksp =5.6×10-12,MgF2的Ksp =7.4×10-11,则在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化成MgF2 |
| C.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)≥c(H+) |
| D.常温下,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
下面是常见的电化学装置图,①②④中均为惰性电极,下列说法错误的是
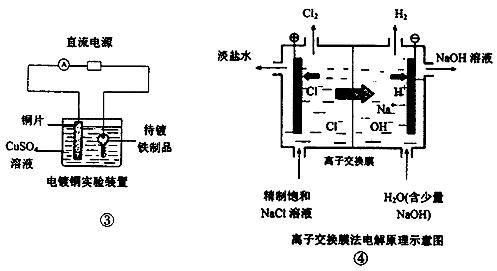
| A.装置①中电解一段时间后,要恢复原溶液,应加入一定量的水。 |
| B.装置②中b极为正极,该极的电极反应方程式为O2+4H++ 4e-=2H2O |
| C.装置③中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g |
| D.装置④中阳极每产生标况下11.2L Cl2,则阳离子交换膜上透过1mol Na+ |
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 |
结论 |
|
| A |
向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4溶液,均有固体析出 |
蛋白质均发生变性 |
| B |
用大理石和盐酸反应制取CO2气体,立即通入Na2SiO3溶液中,出现白色沉淀 |
碳酸酸性强于硅酸 |
| C |
用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色。 |
该溶液一定只含钠元素 |
| D |
常温下,将Al箔插入浓HNO3中,无明显现象。 |
铝和浓硝酸钝化 |