下列现象或事实可用同一原理解释的是
| A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 | B.氯水和活性炭使红墨水褪色 |
| C.漂白粉和钠长期暴露在空气中变质 | D.氯水和过氧化钠使品红褪色 |
相同温度下,反应Br+H2→HBr+H可由过程Ⅰ或过程Ⅱ实现,其能量变化如图所示。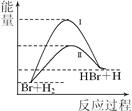
则下列叙述正确的是
| A.该反应为放热反应 |
| B.反应热:过程I>过程II |
| C.过程Ⅱ的平衡常数>过程I的平衡常数 |
| D.形成1 mol 化学键释放的能量:H—Br<H—H |
已知反应A(g)+B(g) nC(g) △H=x kJ·mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如图。
nC(g) △H=x kJ·mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如图。
下列有关叙述一定正确的是
| A.a条件下的反应速率小于b条件下的反应速率 |
| B.其他条件相同时,a表示有催化剂,b表示无催化剂 |
| C.其他条件相同,若a、b表示不同压强下的反应,则n>2 |
| D.其他条件相同,若a、b表示不同温度下的反应,则x>0 |
在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g)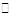 Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
| A.5s内平均反应速率为υ(Y)=" 0.2" mol/( L·s) |
| B.该反应的平衡常数数值为0.5 |
| C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率 |
| D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态 |
高温条件下反应达到平衡时的平衡常数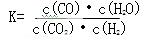 。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
A.反应的热化学方程式可表示为:CO(g)+H2O(g)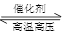 CO2(g)+H2(g) △H<0 kJ/mol CO2(g)+H2(g) △H<0 kJ/mol |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应的正反应为放热反应 |
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol 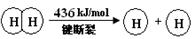
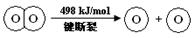
下列说法不正确的是
| A.该反应原理可用于设计氢氧燃料电池 |
| B.破坏1 mol H—O 键需要的能量是463.4 kJ |
| C.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol |
| D.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固 |