某溶液只含有Na+、 Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1。则溶液中Fe3+和SO42-的个数之比为:
| A.3:4 | B.1:4 | C.1:2 | D.3:2 |
下列离子方程式书写正确的是
| A.二氧化碳与氢氧化钠溶液反应:CO2+OH-===CO32-+H2O |
| B.铁与稀硫酸反应:Fe+2H+===Fe2++ H2↑ |
| C.稀硫酸加入到氢氧化钡溶液中:H++OH-===H2O |
| D.氯气通入溴化钾溶液中:Cl2+Br-===Br2+Cl- |
将80gNaOH溶于水配成1L溶液,该溶液的物质的量浓度为
| A.1mol/L | B.2mol/L | C.3 mol/L | D.4mol/L |
下列说法正确的是
| A.32gO2占有的体积约为22.4L |
| B.22.4LN2含阿伏加德罗常数个氮分子 |
| C.在标准状况下,22.4L水的质量约为18g |
| D.22gCO2与标准状况下11.2LHCl所含的分子数相同 |
在反应CuO+H2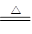 Cu+H2O中,作还原剂的是
Cu+H2O中,作还原剂的是
| A.CuO | B.H2 | C.Cu | D.H2O |
下列几种分散系,能产生丁达尔效应的是
| A.稀硫酸 | B.硫酸铜溶液 |
| C.氢氧化铁胶体 | D.饱和食盐水 |