下列反应的离子方程式正确的是
| A.金属镁与稀盐酸反应 :Mg+2H++2Cl-===MgCl2+H2↑ |
B.氯化钡溶液与硫酸反应 :Ba2++ SO ===BaSO4↓ ===BaSO4↓ |
| C.碳酸钠溶液与盐酸反应 :Na2CO3+2H+===2Na++H2O+CO2↑ |
| D.氢氧化镁与硫酸溶液反应:OH-+H+===H2O |
化合物AB,其中A离子和B离子的电子层结构相同,A、B原子核外最外层电子数A比B少4个,而次外层电子数则A比B多6个,则该化合物可以是()
A.MgO B.CaS C.KF D.MgS
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是()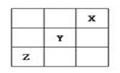
| A.Z一定是活泼的金属元素 |
| B.Y的最高价氧化物的水化物是一种强酸 |
| C.1mol铁跟足量的Z单质化合时,转移的电子为3mol |
| D.Y的氢化物稳定性大于Z的氢化物 |
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O = 4Fe(OH)3↓+O2↑+8Na+则下列说法正确的是()
| A.该反应中Fe2+是还原剂,O2是还原产物 |
| B.4molNa2O2在反应中共得到8NA的电子 |
| C.Fe(OH)3是氧化产物,每生成4mol Fe(OH)3反应过程中共转移电子6mol |
| D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
下列说法正确的是:
| A.酸性氧化物一定是非金属氧化物 | B.酸酐一定是氧化物 |
| C.碱性氧化物一定是金属氧化物 | D.酸性氧化物一定是金属氧化物 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是()
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |