下列说法中正确的是
| A.1mol/L的NaCl溶液是指此溶液中含有1mol NaCl |
| B.从1 L 0.5 mol/L,的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 mol/L, |
| C.25℃、1atm时,1molCl2的体积约为22.4L |
| D.50ml、l mol/L的CaCl2溶液和100ml、2 mol/L的NaCl溶液中的Cl-的物质的量浓度相同. |
下列关于生活材料的说法中,正确的是
| A.三大合成材料是指塑料、合成纤维和复合材料 |
| B.热塑性塑料与热固性塑料均具有线型结构,加热到一定温度都能软化、熔化 |
| C.复合材料一般是以一种材料作为基体,另一种材料作为增强剂 · |
| D.钢化玻璃与普通玻璃的主要成分不同 |
下列化学用语表达不正确的是
A.Na+的结构示意图: 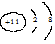 |
B.水分子的电子式: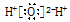 |
| C.二氧化碳的结构式:O=C=O | D.碳酸氢钠的电离方程式:NaHCO3= Na+ + HCO3ˉ |
下列实验中,没有颜色变化的是
| A.淀粉溶液中加入稀硫酸 | B.鸡蛋清中加入浓硝酸 |
| C.淀粉溶液中加入碘酒 | D.葡萄糖溶液与新制氢氧化铜浊液混合加热 |
下列说法正确的是
| A.医疗上常用碳酸钡作X射线透视肠胃的内服药剂,即钡餐 |
| B.人体补碘,所有的食品都应加碘 |
| C.由于近几十年来温室效应加剧,加速了古建筑的风化 |
| D.硅的提纯与应用,促进了半导体元件与集成芯片的发展 |
能正确表示下列化学反应的离子方程式是
| A.氢氧化铜溶液与盐酸的反应:OH- + H+ = H2O |
| B.澄清石灰水与稀盐酸的反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |