在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表. 据此判断下列结论正确的是 ( )
据此判断下列结论正确的是 ( )
| 测定时刻/s |
t1 |
t2 |
t3 |
t 4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B 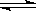 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)] mol·L-1·s-1
化学与生产、生活、社会密切相关。下列有关说法正确的是
| A.用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |
| B.“血液透析”利用了胶体的性质 |
| C.气象环境报告中的“PM2.5”是对一种新分子的描述 |
| D.氢氧化钠可作胃酸的中和剂 |
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是
| A.电流从铜片经导线流向锌片 |
| B.该装置将电能转变为化学能 |
| C.一段时间后,铜片质量减轻 |
| D.锌片发生还原反应 |
下列反应的离子方程式书写正确的是
| A.氯气与氢氧化钠溶液反应:Cl2+ 2OH-=Cl-+ ClO-+ H2O |
| B.碳酸钙与稀醋酸反应:CO32-+ 2CH3COOH =2CH3COO-+ H2O + CO2↑ |
| C.铁粉与稀盐酸反应:2Fe + 6H+=2Fe3+ + 3H2↑ |
| D.铜片与氯化铁溶液反应 Cu + Fe3+=Cu2+ + Fe2+ |
下列关于Cl2性质的说法正确的是
| A.密度比空气小 | B.是无色无味的气体 |
| C.能使干燥的有色布条褪色 | D.可与NaOH溶液反应 |
下列关于甲烷的说法正确的是
| A.能使溴的四氯化碳溶液褪色 | B.是天然气的主要成分 |
| C.不能发生燃烧反应 | D.能发生加成反应 |