常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:(已知:N2O4 2NO2 △H>0)
2NO2 △H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,下列说法中正确的是 ( )
①(a)甲>乙;②(a)甲<乙 ;③(b)甲>乙;④(b)甲<乙
| A.①③ | B.①④ | C.②③ | D.②④ |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.正极上发生的反应是:O2+4e-+2H2O=4OH- |
| B.该电池反应的化学方程式为:CH3CH2OH+3O2点燃2CO2+3H2O |
| C.检测时,电解质溶液中的H+向正极移动 |
| D.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
在体积一定的密闭容器中发生反应:2NH3(g) N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是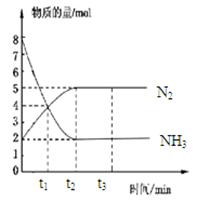
| A.t1时反应达到平衡 |
| B.t3时,v正(N2)﹥v逆(N2) |
| C.t2时和t3时n(H2)相等 |
| D.t3后,若体积不变充He,反应速率增大 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.L2+与R2-的核外电子数相等
B.气态氢化物的热稳定性:H2T>H2R
C.M与T形成的化合物能溶于氨水溶液
D.相同条件下,单质与同浓度稀盐酸反应的速率:M>L
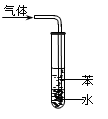
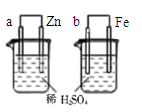
关于下列图示的说法正确的是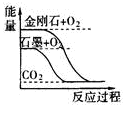


| A.图①表示石墨转变为金刚石是吸热反应 |
| B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅 |
| C.图③吸收NH3并防倒吸 |
| D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b |
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g) 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
| A.达到平衡时,SO2的浓度与SO3的浓度相等 |
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应 2SO2(g)+O2(g)是一个吸热反应 |
| C.为了提高SO2转化率,可适当提高O2浓度 |
| D.升高温度,放热反应的速率增大,吸热反应的速率也增大 |