元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+ 离子半径逐渐减小;化合物XN常温下为气体,据此回答: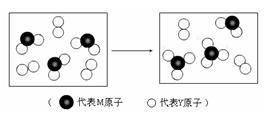
(1)写出Z与N形成化合物的电子式 。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式: 。
(3)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
。
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。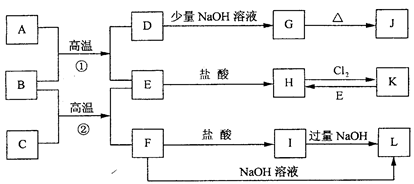
请回答下列问题:
(1)写出下列物质的化学式AK L。
(2)写出F与NaOH反应的化学方程式。
(3)写出B与C高温反应生成E和F的化学方程式:。试列举该反应在工业生产中的应用。
(4)写出D与J的稀溶液反应生成G的离子方程式:。
(5)写出H与强碱反应后一段时间内所能观察出的现象。
(1)写出实验室制NH3的反应方程式为;
(2)硝酸具有强氧化性,它能和许多物质发生反应。写出浓硝酸与非金属单质碳的反应方程式。。
配平下列化学(或离子)方程式:
(3)__FeCl2 + __KNO3 + __HCl — __FeCl3 + __KCl + __NO↑ + __H2O
(4)__SO3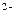 +__MnO4
+__MnO4 +__H
+__H —__Mn
—__Mn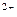 +__SO4
+__SO4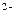 +__H2O
+__H2O
(1)工业上生产普通玻璃的主要原料是、、(填俗名);
(2)写出通过化合反应制取Fe(OH)3的化学方程式:;
(3)写出硅酸钠溶液在空气中变质的离子方程式:;
(4)将CaMg3Si4O12改写为氧化物的形式:;
(5)在氧化还原反应中,水是反应物,但水作氧化剂的化学方程式:。
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)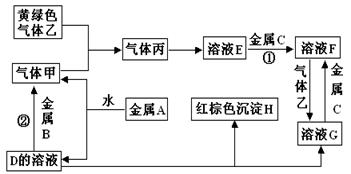
请根据以上信息回答下列问题
(1)写出下列物质的化学式:
A__________________;B_______________; G_____________;乙______________;
(2)写出 下列反应的化学方程式
下列反应的化学方程式
反应①_________________________________________________________________
反应②_________________________________________________________________
(12分)下图是元素周期表中的一部分。
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。
请回答:
(1)硅的相对原子质量为 ;原子序数为8的元素位于元素周期表的第 周期,元素符号为 ,它属于 (填“金属”或“非金属”)元素。
(2)原子半径:钠 镁(填“>”或“=”或“<”,下同),原子得电子能力:硫 氯。