下列实验操作中错误的是( )
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A.常温常压下,16g14CH4所含中子数目为8NA |
| B.标准状况下,22.4LCCl4所含分子数目为NA |
| C.1L0.5mol·L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5NA |
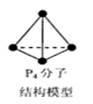
| D.6.2g白磷(分子式为P4,分子结构如右图所示)所含P-P键数目为0.3NA |
下列有关说法错误的是( )
| A.利用铝热反应可以冶炼熔点较高的金属 |
| B.常温下,可以用铁制容器来盛装冷的浓硫酸 |
| C.用作“钡餐”的物质主要成分是硫酸钡 |
| D.人造刚玉熔点很高,可用作高级耐火材料,其主要成分是二氧化硅 |
把VL含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为[Al(OH)4]-;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4。则原混合溶液中Mg2+的浓度为
A.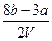 mol·L-1 mol·L-1 |
B.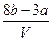 mol·L-1 mol·L-1 |
C.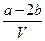 mol·L-1 mol·L-1 |
D.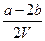 mol·L-1 mol·L-1 |
室温下,向20 mL N mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示。下列说法中,正确的是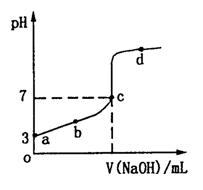
| A.a点c(CH3COOH)=10-3mol·L-1 |
| B.b点溶液中离子浓度大小满足关系: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.c点溶液中离子浓度大小满足关系: c(Na+)+c(OH-)=c(H+)+c(CH3COO-) |
| D.滴定过程中不可能出现: |
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。
C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。
下列说法中,正确的是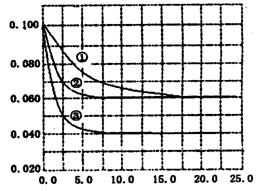
A.反应的平衡常数:①<②
B.反应A+2B C的△H>0
C的△H>0
C.实验②平衡时B的转化率为60%
D.实验③平衡时c(C)=0.040 mol·L-1