用1L 0.1 mol·L-1 BaCl2溶液恰好可使相同物质的量浓度的硫酸铁、硫酸锌和硫酸铝三种溶液中的SO42-完全转化为BaSO4沉淀,则三种硫酸盐溶液的体积之比是( )
| A.3∶2∶3 | B.1∶2∶3 | C.1∶3∶1 | D.3∶1∶3 |
“白色污染”泛指塑料污染,常见的塑料有:①聚乙烯 ②聚丙烯 ③聚氯乙烯 ④聚苯乙烯,下列关于它们的叙述正确的是( )
| A.都是烯烃 |
| B.分子内部都含有双键 |
| C.它们的单体都能发生加聚反应 |
| D.它们的分子结构都是空间网状结构 |
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: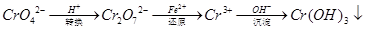
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| B.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 |
CH4 |
C2H2 |
H2 |
| 燃烧热/kJ/mol |
890.3 |
1299.6 |
285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法不正确的是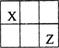
| A.原子半径:Y>Z>W |
| B.一定条件下,Y可置换出X |
| C.气态氢化物稳定性:Z>W |
| D.熔点YW2>XW4 |