2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2 + 7O2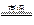 2MoO3 + 4SO2; ②MoO3 + 2N
2MoO3 + 4SO2; ②MoO3 + 2N H3·H2O = (NH4)2MoO4 + H2O;
H3·H2O = (NH4)2MoO4 + H2O;
③(NH4)2MoO4 + 2HCl = H2MoO4↓+ 2NH4Cl; ④H2MoO4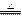 MoO3 + H2O;
MoO3 + H2O;
⑤ 用还原剂将MoO3还原成金属钼。 则下列说法正确的是 ( )
| A.MoS2煅烧产生的尾气可直接排空 |
B.MoO3是金属氧化物,也是碱性 氧化物 氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2 [来 |
根据元素的原子序数,不能确定的是
| A.原子核内质子数 | B.原子核内中子数 | C.原子核外电子数 | D.元素种类 |
下列属于同位素的一组是()
| A.水和重水 | B.O2和O3 | C.氕、氘、氚 | D.40K、40Ca |
下列反应中不能发生的是()
| A.Cl2+ 2KI=2KCl+I2 | B. Cl2+2 NaBr=" 2NaCl+" Br2 |
| C.Br2+ 2KI=" 2KBr+" I2 | D.水溶液中:F2+ 2NaCl="2NaF+" Cl2 |
下列说法正确的是()
| A.卤素元素都有正化合价 | B.卤素元素的单质都只具有氧化性 |
| C.卤素元素的最低化合价都是-1价 | D.卤素元素氢化物都是强酸 |
下列说法不正确的是( )
| A.碱金属元素在化合物中都只显+1价 |
| B.碱金属元素的氧化物都是R2O |
| C.碱金属元素的单质与水反应的剧烈程度不同,最不剧烈的是锂 |
| D.碱金属单质的还原性从上至下依次增强 |