下列离子方程式中正确的是( )
A.过量的NaH SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
C.苯酚钠溶液中通入少量CO2:2 -O-+CO2+H2O→2 -O-+CO2+H2O→2 -OH+CO32- -OH+CO32- |
| D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
铁与稀硫酸反应制取氢气,下列措施一定能使生成氢气的速率加快的是
| A.增大硫酸的浓度 | B.减小硫酸的浓度 |
| C.增加铁的量 | D.加热 |
在一定条件下,反应N2+3H2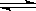 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.V(NH3)=0.02mol/(L·min) | B.V(N2)=0.005mol/(L·min) |
| C.V(NH3)=0.17mol/(L·min) | D.V(H2)=0.03mol/(L·min) |
某元素的气态氢化物的化学式为HX,则X的最高价氧化物的水化物的化学式为
| A.HXO4 | B.HXO3、 | C.HXO | D.H2XO4 |
关于下图装置的叙述,错误的是
| A.铜是正极,其质量不变 |
| B.氢离子在铜表面被氧化,产生气泡 |
| C.电流从铜片经导线流向锌片 |
| D.电子从锌片经导线流向铜片 |
工业制硫酸中的一步重要反应是在400—500度下的催化氧化:2SO2 +O2 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法错误的是
| A.在上述条件下,SO2可能100%的转化为SO3 |
| B.使用催化剂是为了加快反应速率,提高生产效率 |
| C.达到平衡时,SO2与SO3的浓度保持不变 |
| D.为了提高的转化率,可以适当提高O2的浓度 |