某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示: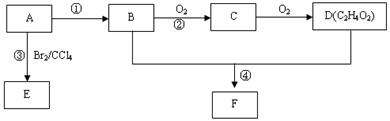

 (1)A的结构式为 ,B中官能团的电子式为 ,
(1)A的结构式为 ,B中官能团的电子式为 , D中官能团的名称为 。
D中官能团的名称为 。 (2)反应①的反应类型是 ,
(2)反应①的反应类型是 ,
反应③的化学方程式为 。
。
 (3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次。该反应的化学方程式为 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次。该反应的化学方程式为 。 (4)D与碳酸氢钠溶液反应的离子方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。 (5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
 试管1中装入药品后加热。图中X的化学式为 。
试管1中装入药品后加热。图中X的化学式为 。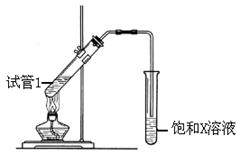
 其作用是 。
其作用是 。 试管1反应的化学方程式为 。
试管1反应的化学方程式为 。
有A、B、C、D四种可溶性盐,它们分别是AgNO3、CuSO4、Na2CO3、BaCl2中的一种,现进行如下实验:
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色。
②若向①的四支试管中分别加盐酸,B的溶液有沉淀产生,D的溶液有无色无味的气体逸出。
根据①、②实验事实,回答下列问题:
(1)写出下列物质的化学式:
A.B.C.D.
(2)写出实验②中有关反应的离子方程式:
__________________________________________________________________;
_________________________________________________________________。
实验室需要500ml 0.4m ol·L-1的NaOH溶液,配制时:
ol·L-1的NaOH溶液,配制时:
(1)称量NaOH固体时,固体应放在__________中置于天平的左盘称量。
(2)配制过程中,下列仪器中肯定不需要使用的是。
(3)根据实验的实际需要和(2)中列出的仪器判断,完成实验还缺少的仪器是(填仪器名称)______________________________。
(4)若实验时遇到下列情况,所配溶液的浓度偏大的是。
| A.加水定容时超过刻度线,又吸出少量水至刻度线 |
| B.忘记将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥处理 |
| D.溶液未冷却即转入容量瓶 |
E.定容时俯视刻度线
完成以下化学反应的方程式:
①钠与水反应:
该反应中,氧化剂为,还原产物为。
②过氧化钠与水的反应:
③氯气与水的反应:
现有以下物质 ①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦酒精⑧稀H2SO4溶液 ⑨KOH固体 (填序号)
(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中,属于非电解质的是
已知下列反应:
①N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。
② 4NH3(g)+5O2(g)=====4NO(g)+6H2O(g);ΔH<0
(1)在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是__________________________________;
(2)为有效提高氢气的转化率,理论上可采取的措施有__________;
| A.降低温度 | B.最适合催化剂活性的适当高温 | C.增大压强 | D.降低压强 |
E.循环利用和不断补充氮气 F.及时移出氨
(3)反应②的化学平衡常数表达式K=________________________,
温度降低时,K值______________(填“增大”、“减小”或“无影响” );
);
(4)在0.5L的密闭容器中,加入2.5mol N2和 7.5mol H2,当该反应达到平衡时,测出平衡混合气的总物质的量为6 mol,则平衡时氮气的转化率=