各物质按强电解质、弱电解质、非电解质、既不是电解质又不是非电解质的顺序排列的一组是C
| A.NaOH、HClO、SO2、H2O | B.NaCl、SO3、NH3、H2O |
| C.BaSO4、NH3•H2O、CO2、Fe | D.H2SO4、H2S、H2O、C2H5OH |
下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.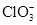 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有4对完全相同的成键电子对 |
D.SiF4和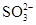 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
氰气的化学式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似,下列叙述正确的是( )
| A.在一定条件下可发生加成反应 |
| B.分子中N≡C键的键长大于C—C键的键长 |
| C.分子中含有2个σ键和4个π键 |
| D.不和氢氧化钠溶液发生反应 |
根据实际和经验推知,下列叙述不正确的是( )
| A.卤化氢易溶于水,不易溶于四氯化碳 |
| B.碘易溶于汽油,微溶于水 |
| C.氯化钠易溶于水,也易溶于食用油 |
| D.丁烷易溶于煤油,难溶于水 |
氯化硼的熔点为10.7 ℃,沸点为12.5 ℃。在氯化硼分子中,氯—硼—氯键角为120°,它可以水解,水解产物之一是氯化氢。下列对氯化硼的叙述中正确的是( )
| A.氯化硼是原子晶体 |
| B.熔化时,氯化硼能导电 |
| C.氯化硼分子是一种极性分子 |
| D.水解方程式:BCl3+3H2O = H3BO3+3HCl |
下列各组混合物中,可以用分液漏斗分离的是
| A.溴苯和水 | B.乙酸和乙醇 | C.酒精和水 | D.溴苯和苯() |