某同学用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是( )
| A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2 |
| B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2 |
| C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间 |
| D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间 |
判断下列反应中氧化性强弱( )
①I2+SO2+2H2O====2HI+H2SO4②2FeCl2+Cl2====2FeCl3③2FeCl3+2HI====2FeCl2+2HCl+I2
A.I2>Fe3+>Cl2> |
B. >Fe3+>Cl2>I2 >Fe3+>Cl2>I2 |
C.Cl2> >Fe3+>I2 >Fe3+>I2 |
D.Cl2>Fe3+>I2> |
下列反应中,水作氧化剂的是( )
| A.Cl2+H2O="===HCl+HClO" | B.C+H2O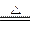 CO+H2 CO+H2 |
| C.CaO+H2O====Ca(OH)2 | D.CO2+H2O====H2CO3 |
下列反应中,属于氧化还原反应的是( )
| A.NaOH+HCl====NaCl+H2O |
| B.2NaOH+CO2====Na2CO3+H2O |
| C.Cu2S+4H2SO4(浓)====2CuSO4+S↓+2SO2↑+4H2O |
| D.Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3+2H2O |
已知反应2X-+Z2====2Z-+X2、2W-+X22X-====+W2能从左向右进行,则反应:W2+2Z-====Z2+2W-进行的方向是( )
| A.从左向右 | B.从右向左 | C.不能进行 | D.无法判断 |
下面三个方法都可以制氯气:
MnO2+4HCl(浓)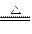 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)====2KCl+2MnCl2+8H2O+5Cl2↑
4HCl(g)+O2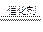 2Cl2+2H2O(g)
2Cl2+2H2O(g)
则三种氧化剂由强到弱的顺序是( )
| A.O2 MnO2 KMnO4 | B.KMnO4 MnO2 O2 |
| C.MnO2 KMnO4 O2 | D.O2 KMnO4 MnO2 |