由短周期元素和长周期元素共同组成的族可能是
| A.0族 | B.主族 | C.副族 | D.Ⅶ族 |
混合下列各组物质使之充分反应,加热蒸干产物并高温下灼烧至质量不变,最终残留固体为纯净物的是()
| A.向CuSO4溶液中加入适量铁粉 |
| B.等物质的量浓度、等体积的FeCl3与KI溶液混合 |
| C.物质的量之比为2:1的NaHCO3与Na2O2溶于水 |
| D.在Na2SiO3溶液中通入过量CO2气体 |
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,下列说法错误的是()
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+2H2O+2e-=2MnOOH+2OH- |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g |
已知: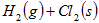
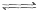
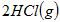 △
△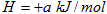
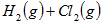
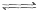
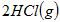 △
△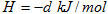
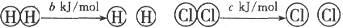 ,
,
且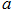 、
、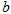 、
、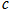 、
、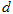 均大于零,则下列说法正确的是()
均大于零,则下列说法正确的是()
A.断开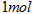 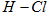 键所需的能量为 键所需的能量为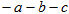 |
B.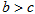 ,则氢气分子具有的能量高于氯气分子具有的能量 ,则氢气分子具有的能量高于氯气分子具有的能量 |
C.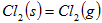 △ △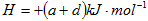 |
D.向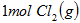 中通入 中通入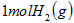 ,发生反应时放热 ,发生反应时放热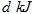 |
下列离子方程式正确的是()
| A.0.01mol/L NH4Al(SO4)2溶液与0.01mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
| C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2= 4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+= Fe3++3NO2↑+3H2O |
已知Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒属于一个氧化还原反应中的反应物和生成物。下列叙述中不正确的是()
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.Fe3+和Fe2+分别属于反应物和生成物 |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e- = Fe3+ |