四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式 。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式 。
(3)Z的最高价氧化物对应水化物的电离方程式 。
(4)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
如图A、B、C、D、E、F六种物质中除D为单质外其余 均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。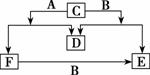
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;
(2)C的电子式是____________________;
(3)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中一种离子是由A、B两元素形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入足量NaOH溶液,加热,部分实验现象如下:产生有刺激气味的气体;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D在周期表中的位置: 周期 族
(2)用离子方程式表示实验②中现象的原因:。
(3)实验③中出现的现象还有 。
(4)经测定甲晶体的摩尔质量为284 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
下图是中学常见物质间的转化关系。已知:
①A为淡黄色固体,B为导致“温室效应”的主要物质; ②E为常见金属,J为红褐色沉淀;
③G在实验室中常用于检验B的存在;④L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色,储存在棕色瓶中。
回答下列问题:
(1)A的电子式____________________________________________________。
(2)反应①的化学方程式为,反应②的离子方程式为,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为L。
(4)L的化学式,G的化学式。
下列框图中的A—J是中学化学中常见的八种物质,所有物质均由短周期元素组成,已知常温、常压下D为无色液体, C、E、G均为气体单质,B为金属,I是由3个原子组成的一元含氧弱酸分子, A—J可发生如下转化:
请填写下列空白:
⑴G的名称为,F的电子式为。
⑵15.6gA与D完全反应,转移的电子的物质的量为。
⑶常温下,A为一种色的固体,它的一种重要用途是 。
。
⑷写出D、G反应转化为I和J的离子方 程式
程式 。
。
⑴某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是____;若反应过程中转移了0.3moL电子,则氧化产物的质量是__g。
⑵将a mol Cl2 通入含b mol FeBr2的溶液中,
当0< a / b≤1/2 时,反应的离子方程式为: 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,
写出另2个可能发生的离子方程式:
①当 a / b =1时,_____________________________;
②当a / b≥3/2时,_____________________________。
⑶观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O NH4++ OH_
NH4++ OH_
Ⅰ.已知B(OH)3是一元弱酸,试写出其电离方程式__________________________
Ⅱ.N2H4是二元弱碱,试写出其第二步电离方程式____________________________