茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
【查阅部分资料】:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 ____ 。
(2)写出检验Ca2+的离子方程式 ___ 。
(3)步骤⑤中需要使用的主要玻璃仪器有 。
写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,发生反应的离子方程式 。
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是____________________________。
X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是________,丙分子的电子式为________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为___________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
用电子式表示下列物质的结构:
(1)NH4Cl____________;(2)Na2O________________;(3)Na2O2________;(4)H2S________;(5)CO2________;(6)MgCl2________;
(1)~(6)中,仅含离子键的是________,仅含共价键的是________,既有离子键又有共价键的是________。
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的 He、
He、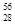 Ni、
Ni、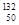 Sn、Pb等尤为稳定。根据此信息回答下列问题:
Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号__________________。
(2)已知氧有三种同位素 O、
O、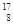 O、
O、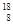 O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算,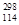 R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性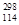 R__________
R__________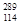 R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为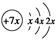 ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为 ,则下列叙述中正确的是
,则下列叙述中正确的是
( )。
| A.原子序数:a>b>c | B.d单质最活泼 |
| C.原子半径:a>c>d | D.最高价氧化物对应的水化物的酸性:d>a>c |