下列溶液中微粒浓度关系一定正确的是
| A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+] |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合: [OH-]= [H+] |
| C.0.1 mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+] |
| D.0.1 mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+2[H2S] |
常温下,用 0.1000 mol·L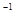 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L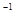 CH3COOH溶液所得滴定曲线如图。下列说法正确的是
CH3COOH溶液所得滴定曲线如图。下列说法正确的是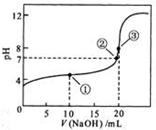
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现: |
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
按图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)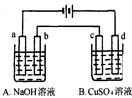
| A.4 | B.3 | C.2 | D.1 |
反应CO(g)+H2O(g) 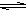 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆)B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
下列各组混合物中,总质量一定时,二者以不同比例混合,完全燃烧时,生成CO2的质量不一定的是
| A.乙炔、苯乙烯 | B.甲烷、辛醛 |
| C.甲苯、对二甲苯 | D.乙烯、庚烯 |
现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| B.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| C.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |