实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
某化工厂排放的污水中含有Al3+、Fe3+、Hg2+、Cu2+四种离子。甲、乙、丙三同学设计从该污水中回收金属铜的方案如下:
甲:污水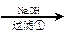
 +++++++++++
+++++++++++
乙:污水
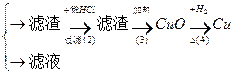
丙:污水
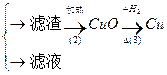
填空和回答:
(1)甲、乙、丙提出的方案能否制得铜?
甲:____________________;乙:____________________;丙:____________________。
(2)在能制得铜的方案中,会导致环境污染的一步操作是:_____________________________
______________________________________________________________________________。
本题中所有的气体体积均为标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中A、B同周期且原子半径A>B。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验:
a.向第一份试样中加入过量的盐酸,充分反应后,放出0.896 L气体,还剩下0.56 g的残渣;
b.向第二份试样中加入过量的10%的NaOH溶液,充分反应后,放出0.896 L气体,还剩下0.96 g的残渣;
c.将第三份试样隔绝空气加强热后,生成一种固体,冷却后,再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质B是__________________。
(2)混合物中A的质量分数是__________________。
(3)写出实验c中有关反应的化学方程式并计算x的值。
某学习小组对炭粉与氧化铁反应产物中气体的成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳(CO2)。
(2)设计方案:将一定量的氧化铁与炭粉的混合物在隔绝氧气的条件下完全反应(如下图),测定参加反应的碳元素与氧元素的质量比。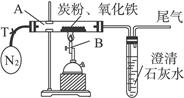
实验装置
(3)查阅资料:N2不与炭粉以及氧化铁发生反应,可用于隔绝氧气进行反应。
(4)实验操作:
①称取5.2 g氧化铁与炭粉的混合粉末,放入48.48 g的玻璃管中,按上图连接后必不可少的实验操作为___________________________________________________。
②加热前,先通一段时间纯净、干燥的氮气,其目的是_____________________________。
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明_____________________。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24克。
(5)数据处理:经计算,参加反应的碳元素质量为0.48克,氧元素质量为0.96克。
(6)得出结论:根据数据处理结果,反应生成的气体为CO和CO2,而且同条件下体积比为1∶1,原假设不成立,理由为__________________________________________________。
(7)该实验反应的化学方程式为_________________________________________________。
在如下图所示的物质转化关系中,A是一种固体单质,E是一种白色不溶物,请完成下列问题:
(1)B的化学式为___________,目前B已被用作_____________________的主要原料。
(2)B和a溶液反应的离子方程式:________________________________________________。
(3)A和a溶液反应的离子方程式:_____________________________________________。
(4)C和过量盐酸反应的离子方程式:___________________________________________。
把河沙(主要成分是SiO2)与镁按一定质量比(质量之比约为15∶24)混合均匀,装入试管中加热大约1 min后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀H2SO4的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的化学反应方程式:_________________________,该反应是_____________(填“放热”或“吸热”)。
(2)生成的混合物放入稀H2SO4中,产生的气体是_____________。
(3)写出产生“爆炸声”的化学反应方程式:_________________________________。