硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 + 4C →高 温 Na2S + 4CO
② Na2SO4 + 4 CO→高 温 Na2S + 4CO2
(1)现要制取Na2S 7.8克,需要无水芒硝(Na2SO4) g;
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量范围n的范围是 < n < ;
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2 g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为 mol;Na2SO3的物质的量为 mol;Na2SO4的物质的量为 mol。
有A、B、C、D、E五瓶溶液,它们都是中学化学中常用的无机试剂。B,C,D都是硫酸盐溶液,现进行如下实验:
①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白色烟雾;
将A分别加入其它溶液中,只有B、C中有沉淀生成;且沉淀颜色分别为红褐色和白色。其中白色沉淀不但可以溶于盐酸也可以溶于氢氧化钠。
②蘸有A的玻璃棒与蘸有E的浓溶液的玻璃棒接近时也产生白色烟雾;且E常温下跟铁、铝这些金属接触会发生钝化现象。
③D溶液进行焰色反应时火焰为黄色。
根据上述实验信息,请回答下列问题:
(1)请写出下列溶液溶质的化学式:ADE
(2)请写出A与C反应的离子方程式
(3)请写出鉴定B溶液阳离子方法及现象
我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答下列问题:(已知Cl2+SO2+2H2O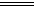 H2SO4+2HCl)
H2SO4+2HCl)
①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________ 。
。
②如果将刚取样的上述雨水和自来水相混合,pH将变________(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是 ________。
________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在20世纪的60年代~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(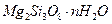 )等化合物。
)等化合物。
(1)三硅酸镁的氧化物形式为_______
(2)铝原子的原子结构示意图为,写出氢氧化铝与胃酸反应的离子方程式。
(3)Al2O3、MgO和SiO2都可以制耐火材料, 其原因是______。
| A. Al2O3、MgO和SiO2都不溶于水 | B.Al2O3、MgO和SiO2都是白色固体 |
C.Al2O3、MgO和SiO 2都是氧化物 2都是氧化物  |
D.Al2O3、MgO和SiO2都有很高的熔点 |
某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x的值。通过查阅资料该小组同学得知:草酸易溶于水,其水 溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+
溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+2Mn2++10CO2↑+8H2O。该组同学利用该反应原理设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
| 滴定次数 |
待测草酸溶液体积(mL) |
0.1000 mol/LKMnO4标准溶液体积(mL) |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 第一次 |
25.00 |
0.00 |
10.02 |
| 第二次 |
25.00 |
0.22 |
11.32 |
| 第三次 |
25.00 |
1.56 |
11.54 |

请回答:
(1)滴定时,将KMnO4标准液装在右图中的(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是。
(3)通过上述数据,计算出x=。
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会。
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______________________________。
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为__________________________________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=_______。