已知 、
、 、
、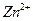 较完全地形成氢氧化物沉淀,溶液的pH分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量
较完全地形成氢氧化物沉淀,溶液的pH分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量 、
、 杂质离子,为除去这些离子制得纯净的硫酸锌,应加入的试剂是:
杂质离子,为除去这些离子制得纯净的硫酸锌,应加入的试剂是:
A.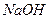 溶液 溶液 |
B. 、 、 |
| C.氨水 | D.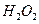 、 、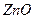 |
某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种元素的原子核内中子数为
A.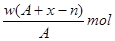 |
B.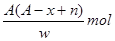 |
C.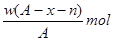 |
D.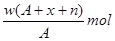 |
已知25 ℃、101 kPa下,下列反应
C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。
C(金刚石) + O2(g) === CO2(g),燃烧1 mol C(金刚石)放热395.41 kJ。
可以得出的结论是
| A.金刚石比石墨稳定 | B.1 mol石墨所具有的能量比1 mol金刚石低 |
| C.金刚石转变成石墨是物理变化 | D.石墨和金刚石都是碳的同位素 |
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436KJ/mol、243KJ/mol和431KJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为
| A.放热91.5KJ | B.放热183KJ | C.吸热183KJ | D.吸热91.5KJ |
下列说法正确的是
A.用电子式表示氯化氢分子的形成过程: |
| B.一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 |
| C.酸与碱发生中和反应时放出的热量叫中和热 |
| D.催化剂不但能改变反应速率,也能改变反应进行的限度 |
下列变化过程中,化学键没有被破坏的是
| A.HCl溶于水 | B.干冰升华 |
| C.固体NaCl熔融 | D.煤矿中瓦斯(主要成分CH4)遇火爆炸 |