在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡
CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.溶液PH等于1 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)降低 |
| D.加入少量CH3COONa固体,平衡向左移动,导电能力不变 |
由CO2、H2、和CO组成的混合气在同温同压下与氮气的密度 相同。则该混合气中CO2、H2、和CO的体积比为 ( )
相同。则该混合气中CO2、H2、和CO的体积比为 ( )
| A.29︰8︰13 | B.22︰1︰14 | C.13︰8︰29 | D.26︰16︰57 |
已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为 ( )
| A.39︰61 | B.61︰39 | C.1︰1 | D.39︰11 |
原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是19177Ir,则其核内的中子数是 ( )
| A.77 | B.114 | C.191 | D.268 |
某有机样品3.1 g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1 g,经过滤得到10 g沉淀。该有机样品可能是()
| A.乙酸 | B.乙醇 | C.乙醛 | D.甲醇和丙三醇的混合物 |
下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图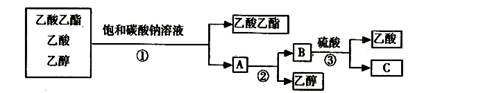
上述试验过程中,所涉及的三次分离操作分别是()
| A.①蒸馏②过滤③分液 | B.①分液②蒸馏③蒸馏 |
| C.①蒸馏②分液③分液 | D.①分液②蒸馏③结晶、过滤 |