下列有关氧化还原反应的叙述中,正确的是
| A.一定有电子的转移 | B.氧化反应一定先于还原反应发生 |
| C.氧化剂发生氧化反应 | D.其本质是元素化合价发生变化 |
反应4 (气)+5
(气)+5 (气)
(气) 4NO(气)+6
4NO(气)+6 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为()
(X)(反应物的消耗速率或产物的生成速率)可表示为()
A (NH3)=0.0100mol.L-1.s-1 B
(NH3)=0.0100mol.L-1.s-1 B  (O2)=0.0010mol.L-1.S-1
(O2)=0.0010mol.L-1.S-1
C  (NO)=0.0010mol.L-1.s-1 D
(NO)=0.0010mol.L-1.s-1 D (H2O)=0.045mol.L-1.s-1
(H2O)=0.045mol.L-1.s-1
NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是()
| A.使用适当的催化剂不改变反应速率 | B.降低压强能提高反应速率 |
| C.升高温度能提高反应速率 | D.改变压强对反应速率无影响 |
在10℃时某化学反应速率为0.1 mol/(L•s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L•s),该反应需在什么温度下进行?()
| A.30℃ | B.40℃ | C.50℃ | D.60℃ |
在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是()
| A.0.02 mol/(L•min) | B.1.8mol/(L•min) | C.1.2 mol/(L•min) | D.0.18 mol/(L•min) |
在m A + n B 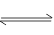 p C的反应中,m.n.p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为 ()
p C的反应中,m.n.p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为 ()
| A.2:3:2 | B.2:3:3 | C.1:3:2 | D.3:1:2 |