下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH=+1.9KJ/mol ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3KJ/mol ,若将0.5 mol浓H2SO4溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
把mmolC2H4跟nmolH2 混合在密闭容器中,在适当条件下,反应达到平衡时生成pmolC2H6,若将所得平衡混和气体完全燃烧需要的氧气的物质的量为
| A.3m+nmol | B.3m+n/2mol |
| C.3m+3p+n/2mol | D.3m+n/2-3pmol |
氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
| A.Q1 + Q2>Q3 | B.Q1 + Q2<2Q3 |
| C.Q1 + Q2<Q3 | D.Q1 + Q2>2Q3 |
如图将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是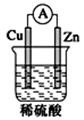
| A.溶液的pH增大 | B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42-浓度增大 | D.溶液的密度增大 |
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如下图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,根据以上信息判断,下列说法正确的是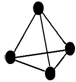
| A.1 mol N4转变成N2将放出882 kJ热量 |
| B.N4属于一种新型的化合物 |
| C.N4与N2互为同分异构体 |
| D.N4是由极性键组成分子 |
可逆反应3H2+N2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
①消耗3 mol H2的同时生成2 mol NH3
②1个N≡N键断裂的同时,有3个H-H键形成
③H2、N2与NH3的物质的量之比为3∶1∶2
④1个N≡N键断裂的同时,有6个N-H键断裂
⑤1个N≡N键断裂的同时,有6个N-H键形成
| A.①②⑤ | B.②④ | C.①②③④ | D.全部 |