氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: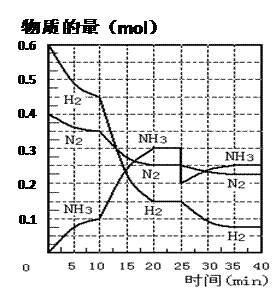
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为: ,
第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),
第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数
K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
某化学小组用环己醇制备环己烯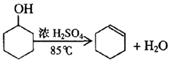
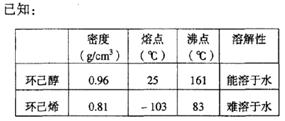
制得的环己烯粗品中含有环己醇和少量酸性杂质等。
(1)为制备环己烯精品:
①加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是。
口进入。蒸馏时要加入生石灰,目的是。
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(2)在环己烯精品中滴加溴的CCl4溶液,发生反应的化学方程式。
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。 已知:常温下,CO能使一些化合物中的金属离子还原。
已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是 (填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的 CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 。
CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是 。
(2)假设CO2气体为足量, 在实验过程中分别产生以下两种不同情况,请分析并回答问题:
在实验过程中分别产生以下两种不同情况,请分析并回答问题:
①装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
|
(3)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。 。
甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互 溶,加热至160℃即分
溶,加热至160℃即分 解成二氧化碳和氢气。
解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH H2O+CO↑,
H2O+CO↑,
实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
①从下图挑选所需的仪器,画 出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。



分液漏斗长颈漏斗蒸馏烧瓶集气瓶温度计
②装置Ⅱ的作用是。
(2)实验室可用甲酸制备甲酸 铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3="=" Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O== 2 Cu(HCOO)2·4H2O+ CO2↑
2 Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备: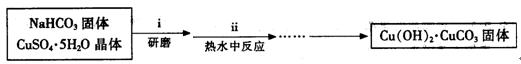
③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是。
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到(填写实验现象),说明温度过高。
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是。
⑥用乙醇洗涤晶体的目的是。
有机高分子化合物A常用作木材的粘合剂,俗称“白乳胶”。B通过加聚反应可制得A。B的蒸气对H2的相对密度为43,分子中C、H、O的原子个数之比为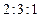 。B在酸性条件下水解可生成碳原子数相同的两种有机物D和M。
。B在酸性条件下水解可生成碳原子数相同的两种有机物D和M。
(1)B分子中含氧的官能团的名称为 。
(2)B的同分异构体中属于不饱和羧酸的有3种,它们是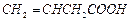 、
、
、 。
(3)写出B在一定条件下生成A的化学方程式 。
(4)通常羟基与双键碳原子直接相连接时,易发生下列转化:
M能发生银镜反应,请写出M的结构简式 。
(5)已知:
D可以发生如下转化关系:
有机物N与G互为同系物,且N的相对分子质量比G大14,写出两分子N在一定条件下生成的六元环状化合物的结构简式 。并写出N发生消去反应的化学方程式 。
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示: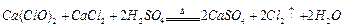 。某学习小组利用此原理设
。某学习小组利用此原理设 计如图所示装置制取氯气并探究其性质。
计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是 (填字母);指出a中m仪器的名称 。
|


 加试剂的名称、至少填二种)方法 、
加试剂的名称、至少填二种)方法 、
 溶液:
溶液: ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。