铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________NA,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式__________ _。
现有下列物质:①铜 ②熔融氯化钠 ③氯化氢 ④CO2⑤NaHSO4固体 ⑥氨水
按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 |
能导电的物质 |
电解质 |
非电解质 |
| 属于该类的物质 |
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的原子结构示意图为;M在元素周期表中的位置为;前五种元素的原子半径从大到小的顺序是(用元素符号表示)。Z、L两元素的第一电离能大小关系为:>(填写元素符号),原因。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子构型为,B的结构式为。
(3)N是人体必需的微量元素,与L同一主族,N原子比L原子多两个电子层,则N的电子排布式为,其最高价氧化物对应的水化物化学式为。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol H2N反应热的是__________(填字母代号)。
| A.+99.7 mol·L-1 | B.+29.7 mol·L-1 |
| C.-20.6 mol·L-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:;由R生成Q的化学方程式:。
氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)下列有关反应方程式不正确的是(填选项标号)。
A.(CN)2和NaOH溶液反应:(CN)2 + 2OH-= CN-+ CNO-+ H2O
B.MnO2和HCN反应:MnO2 + 4HCN  Mn(CN)2 + (CN)2↑ + 2H2O
Mn(CN)2 + (CN)2↑ + 2H2O
C.向KCN溶液中加入碘水:I2 + 2KCN =" 2KI" + (CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2 + 2Br-= 2Cl-+ Br2
(2)HCN的电子式为。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b=。
(10) 无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取原溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取原溶液少许,加入氨水有白色沉淀生成继续加入过量氨水,沉淀不消失;
④取原溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)根据上述实验判断原溶液中上述离子肯定存在的是,肯定不存在的是。
(2)写出与②③两个实验有关的离子方程式:②③
(11分) 铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: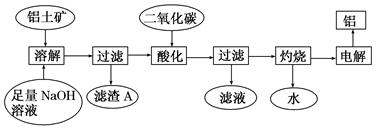
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式:_____________________
(2)滤渣A的主要成分为____________;滤渣A的用途是____________(只写一种);实验室过滤时使用玻璃棒,其作用是__________.
(3)在工艺流程第三步中,选用过量二氧化碳作酸化剂的原因是(只用离子方程式表示)
_________________________________________________________________
(4)若将铝溶解,下列试剂中最好选用____________(填编号).
A.浓硫酸 B.稀硫酸 C.稀硝酸