向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是( )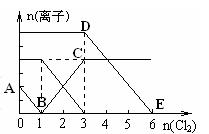
| A.线段BC代表Fe3+ 物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)= 6mol |
| C.当通入Cl22mol时,溶液中已发生的离子反 应可表示为:2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
| D.原溶液中n(Fe2+): n(I━): n(Br━)=2:1:3 |
下列叙述或表示正确的是()
| A.常温下pH均为3的醋酸和硫酸的水溶液,分别加水稀释100倍后,两种溶液的pH仍相同 |
| B.氢氧化钙溶液中加入过量的碳酸氢钙溶液的离子方程式:Ca2+ + HCO3—+OH— = CaCO3 ↓+ H2O |
| C.Ksp反映了难熔电解质在水中的溶解能力,它的大小与浓度无关,与温度无关。 |
| D.c(H+)=1×10-2 mol·L的溶液:Fe2+、Ba2+、N03-、Cl-不能大量共存。 |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是
| A.J和氢组成的化合物分子中只含有极性共价键 |
| B.工业上用电解熔融的M的氧化物方法来制备M |
| C.R、T两元素的气态氢化物中,T的气态氢化物更稳定 |
| D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |
将0.2 mol·L-1的HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是()
| A.c(HCN)<c(CN-) | B.c(Na+)> c(CN-) |
| C.c(HCN)=c(CN-)= c(Na+) | D.c(HCN)+c(CN-)="0.2" mol·L-1 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 2A(气)+B(气) 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小;
③ 2 s 时物质 A 的转化率为70%④ 达到平衡状态时,增加A物质的量A和B转化率都提高。⑤当各物质浓度满足c(A)="2c(B)=" c(C)时,该反应达到了平衡状态;其中正确的是()
A.①③B. ①②C. ②③D. ③④
下列物质的化学用语正确的是
①NH4H的电子式
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
⑦sp2杂化轨道模型:
| A.②③⑤ | B.①③⑤⑥ | C.③⑥⑦ | D.②③⑥⑦ |