用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是( )
| A.称量时,将固体NaOH直接放在天平右盘上 |
| B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 |
| C.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
| D.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 |
某元素的原子核外有3个电子层,最外层有4个电子,该元素处于
| A.第3周期ⅥA族 | B.第3周期ⅥB族 |
| C.第3周期ⅣB族 | D.第3周期ⅣA族 |
某主族元素最外层只有1个电子,则该元素一定是
| A.ⅠA族元素 | B.第ⅦA元素 | C.第三周期元素 | D.金属元素 |
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 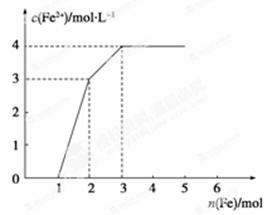
| A.1∶1∶1 | B.1∶3∶1 | C.3∶3∶8 | D.1∶1∶4 |
已知X、Y、Z三种主族元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是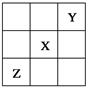
| A.Y与Z的原子序数之和可能为2a | B.Y的原子序数可能为a-17 |
| C.Z的原子序数可能为a+31 | D.X、Y、Z一定为短周期元素 |
在一定温度下,反应1/2H2(g)+1/2 X2(g)  HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
| A.5% | B.100% | C.25% | D.33% |