相同条件下,气体A与氧气的质量比为2∶1,体积比为4∶1,气体A的相对分子质量是( )
| A.16 | B.17 | C.44 | D.64 |
下列说法错误的是( )
| A.ns电子的能量不一定高于(n-1)p电子的能量 |
| B.6C的电子排布式1s22s22px2违反了洪特规则 |
| C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 |
| D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
某原子核外共有6个电子,分布在K与L电子层上,其原子在L层分布中能量最低的是( )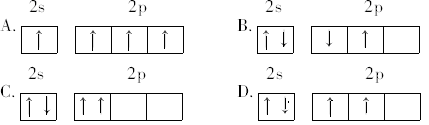
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是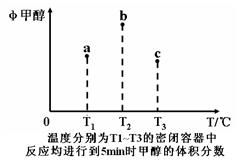
| A.该反应的正反应的△H>0 |
| B.反应进行到5min时,a容器中v正=v逆 |
| C.减压可将b中的平衡状态转变成c中的平衡状态 |
| D.达到平衡时,a、b、c中CO的转化率为b>a>c |
活性氮原子与二氧化氮反应(N+NO2)同时有四组气体产物:①N2O+O;②2NO;③N2+2O;④N2+O2。测得产物气体平均相对分子质量为28.7,第③组产物所占比例为
| A.13% | B.23% | C.33% | D.43% |
2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
| A.反应后溶液中存在Fe3+和Fe2+ | B.1.12L气体是NO、NO2的混合气体 |
| C.反应后溶液中c(NO3-)=0.85mol·L-1 | D.反应后的溶液最多还能溶解1.4gFe |