下列关于物质结构与性质的叙述中,正确的是
| A.水分子中O-H键的键能很大,因此水的沸点较高 |
| B.因为蛋白质分子与胶体颗粒大小相近,故蛋白质溶液具有胶体的某些性质 |
| C.有机物的同分异构体之间性质一定有明显差异 |
| D.因苯环对羟基的影响,使苯酚具有较强的酸性,能与NaHCO3溶液反应放出CO2 |
下列物质既能跟盐酸反应,叉能跟NaOH溶液反应的是 ①SiO2②Al ③Al2O3④Al(OH)3⑤Na2CO3溶液 ⑥Ca(HCO3)2溶液⑦NH4HCO3溶液⑧KHSO4溶液
| A.④⑥⑦⑧ | B.②③④⑥⑦ | C.①②③④⑦ | D.②③④⑤⑧ |
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是
| A.在0-a范围内,只发生中和反应 |
| B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑ |
| C.a=0.3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
某小组为研究电化学原理,设计如图装置。下列叙述错误的是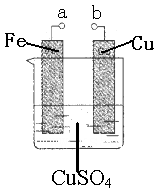
| A.a和b不连接时,铁片质量会增加 |
| B.a和b用导线连接时,正极发生的电极反应为:Cu2++2e-=Cu |
| C.无论a和b是否连接,铁片均被腐蚀 |
| D.a和b分别连接电源正、负极时,Fe电极发生的电极反应为:4OH--4e-=2H2O+O2↑ |
在水溶液中能大量共存的一组离子是
| A.Na+、Al3+、Cl-、CO32- | B.H+、Na+、Fe2+、MnO4- |
| C.K+、Ca2+、Cl-、NO3- | D.K+、NH4+、OH-、SO42- |