以下实验原理或操作中,正确的是
| A.室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| B.焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧 |
| C.中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 |
| D.纸层析中,滤纸作为固定相,展开剂作为流动相 |
在相同条件下,一定量的氢气在氧气中充分燃烧并放出热量。若生成液态水放出的热量为Q1;若生成气态水放出的热量为Q2。那么Q1与Q2之间的大小关系是()
| A.Q1>Q2 | B.Q1<Q2 |
| C.Q1=Q2 | D.不能确定 |
已知热化学方程式2H2(g)+O2(g)====2H2O(l)ΔH1="-571.6" kJ·mol-1,则关于化学方程式2H2O(l)====2H2(g)+O2(g) ΔH2的说法中正确的是()
| A.方程式中化学计量数表示分子数 |
| B.该反应ΔH2大于零 |
| C.该反应ΔH2="-571.6" kJ·mol-1 |
| D.该反应可表示36 g水分解时的热效应 |
下列关于反应能量的说法正确的是()
| A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s) ΔH="-216" kJ·mol-1,E反应物<E生成物 |
| B.CaCO3(s)====CaO(s)+CO2(g) ΔH="+178.5" kJ·mol-1, E生成物>E反应物 |
C.HI(g)====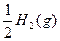 + +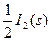 ΔH="-26.5" kJ·mol-1,1 mol HI在密闭容器中分解达平衡时放出26.5 kJ的能量 |
| D.H+(aq)+OH-====(aq)H2O(l) ΔH="-57.3" kJ·mol-1,1 L 1 mol·L-1的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放热57.3 kJ |
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol OO键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为()
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
下列说法不正确的是()
| A.物质发生化学反应的反应热仅指反应放出的热量 |
| B.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 |
| C.所有的燃烧都是放热反应 |
| D.热化学方程式中分子式前面的化学计量数可以是分数 |