某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s)ΔH>0下列叙述正确的是
Z(g)+W(s)ΔH>0下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,上述反应的ΔH增大 |
下列说法或表述中正确的是
A.烷烃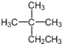 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
| B.由石油分馏可以获得石蜡,由石蜡裂化可以获得乙烯 |
C.如图所示的有机物分子式为C14H12O2,能发生银镜反应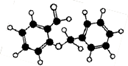 |
| D.在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
某有机物A用质谱仪测定如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为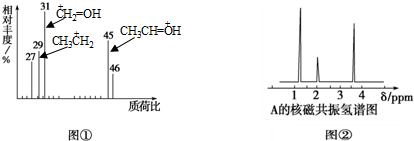
| A.HCOOH | B.CH3CHO | C.CH3CH2OH | D.CH3CH2CH2COOH |
某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述中正确的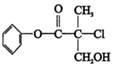
| A.有机物A属于芳香烃 |
| B.有机物A可以和Br的CCl4溶液发生加成反应 |
| C.有机物A和浓硫酸混合加热,可以发生消去反应 |
| D.有机物A可与NaOH溶液反应,生成多种可溶于水的化合物 |
如下图的有机物中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为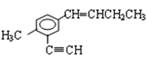
| A.11、4 | B.10、3 | C.12、4 | D.13、4 |
以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为
| A.加成反应-消去反应-取代反应 |
| B.消去反应-加成反应-取代反应 |
| C.消去反应-取代反应-加成反应 |
| D.取代反应-加成反应-消去反应 |